Uniones entre Átomos y Moléculas: Tipos y Características Esenciales
¿Qué son las uniones químicas y por qué son importantes?
Las uniones entre átomos y moléculas son la base de toda la materia que nos rodea. Desde el aire que respiramos hasta el agua que bebemos, todo está compuesto por átomos que se unen de diferentes maneras. Pero, ¿alguna vez te has preguntado cómo se forman estas uniones y por qué son tan esenciales para la existencia de la vida? En este artículo, vamos a explorar los diferentes tipos de uniones químicas, sus características, y cómo estas interacciones moldean el mundo que conocemos. Así que, ¡abróchate el cinturón y vamos a sumergirnos en el fascinante mundo de la química!
La química puede parecer un tema complicado, pero en realidad es como un gran rompecabezas. Cada átomo es una pieza que, cuando se une a otras, crea algo más grande y complejo. Hay varios tipos de uniones, y cada una tiene sus propias características y propiedades. Vamos a desglosar estos tipos de uniones para que puedas entender cómo funcionan y por qué son tan cruciales.
Tipos de Uniones Químicas
1. Uniones Iónicas
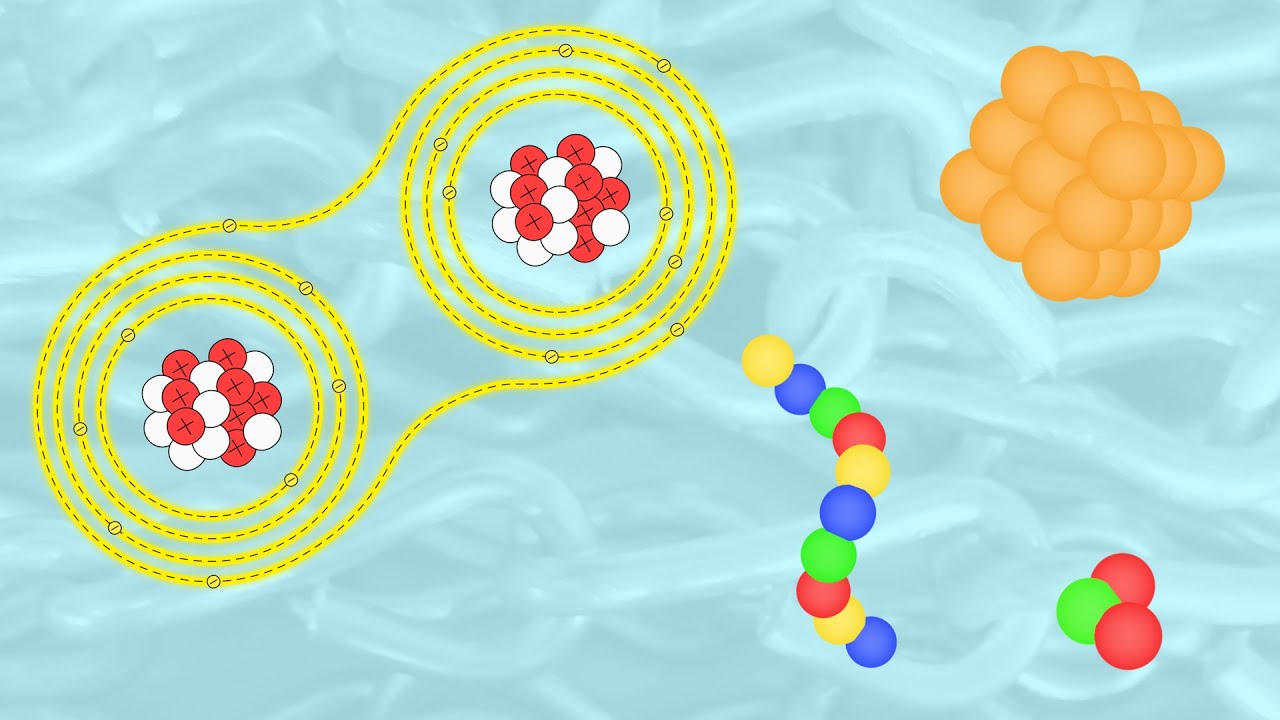
Las uniones iónicas son como un matrimonio entre dos átomos que se complementan perfectamente. En este tipo de unión, un átomo cede uno o más electrones a otro átomo. Este proceso genera cargas eléctricas opuestas: uno se convierte en un ion positivo (catión) y el otro en un ion negativo (anión). La atracción entre estas cargas opuestas es lo que mantiene unidos a los átomos. Un ejemplo clásico de esto es la sal de mesa (NaCl), donde el sodio (Na) entrega un electrón al cloro (Cl).
¿Te imaginas una pareja que se complementa en sus debilidades? Así es como funcionan las uniones iónicas. Son fuertes, pero también pueden ser frágiles. Por ejemplo, si las sales se disuelven en agua, se separan en sus iones constituyentes. Este fenómeno es la razón por la cual la sal se disuelve en agua, lo que nos lleva a la siguiente categoría.
2. Uniones Covalentes
Ahora, hablemos de las uniones covalentes, que son un poco más como una sociedad entre amigos. En este caso, los átomos comparten electrones en lugar de transferirlos. Esto les permite alcanzar una configuración más estable. Un ejemplo sencillo es el agua (H2O), donde el oxígeno comparte electrones con dos átomos de hidrógeno.
Las uniones covalentes pueden ser simples, dobles o triples, dependiendo de cuántos electrones se compartan. Piensa en esto como un grupo de amigos que deciden compartir recursos para lograr un objetivo común. Cuantos más amigos compartan, más fuerte es la unión. Sin embargo, a diferencia de las uniones iónicas, las covalentes pueden ser más flexibles y variadas en su naturaleza.
3. Uniones Metálicas
Las uniones metálicas son como una gran fiesta donde todos los átomos se mezclan y comparten libremente. En este tipo de unión, los electrones de valencia son compartidos por un gran número de átomos metálicos, creando una «nube» de electrones. Esto da como resultado propiedades únicas, como la conductividad eléctrica y térmica, así como la maleabilidad y ductilidad de los metales.
Imagina una multitud en una fiesta donde todos están bailando juntos. Esa es la esencia de las uniones metálicas: la libertad de movimiento. Este tipo de unión es responsable de muchas de las características que hacen que los metales sean útiles en la vida cotidiana, desde la construcción hasta la electrónica.
Características de las Uniones Químicas
Estabilidad y Energía
La estabilidad de una unión química está relacionada con la energía. Cuando los átomos se unen, liberan energía, lo que significa que el sistema se vuelve más estable. Piensa en ello como en un niño que se siente más seguro al tener un amigo a su lado. La energía liberada durante la formación de una unión química es lo que hace que esas uniones sean atractivas para los átomos. Por el contrario, cuando una unión se rompe, se requiere energía para hacerlo, lo que puede verse como una especie de «desacuerdo» entre los átomos.
Polaridad de las Uniones
La polaridad es otra característica clave de las uniones químicas. Algunas moléculas son polares, lo que significa que tienen una distribución desigual de electrones, mientras que otras son no polares, donde los electrones están distribuidos de manera más uniforme. Esta diferencia en la polaridad puede afectar cómo interactúan las moléculas entre sí. Por ejemplo, el agua es polar y, por lo tanto, se disuelve en otras sustancias polares, mientras que el aceite, que es no polar, no se mezcla con el agua.
¿Alguna vez has tratado de mezclar agua y aceite? Es como intentar unir dos mundos completamente diferentes. Esta propiedad es fundamental en biología y química, ya que influye en la forma en que las sustancias se combinan y reaccionan.
Importancia de las Uniones Químicas en la Vida Diaria
Desde el Agua hasta los Medicamentos
Las uniones químicas son esenciales en casi todos los aspectos de nuestra vida diaria. Desde el agua que bebemos hasta los medicamentos que tomamos, todo está basado en estas interacciones. Por ejemplo, el agua, que es vital para la vida, es el resultado de uniones covalentes entre hidrógeno y oxígeno. Sin estas uniones, no existiría la vida tal como la conocemos.
Los medicamentos, por otro lado, son diseñados específicamente para interactuar con ciertas uniones químicas en el cuerpo. A través de uniones químicas, los fármacos pueden unirse a proteínas y otros compuestos en nuestras células, desencadenando reacciones que pueden curar enfermedades o aliviar síntomas.
En el Mundo Natural
Las uniones químicas también son fundamentales en el mundo natural. La fotosíntesis, el proceso mediante el cual las plantas convierten la luz solar en energía, depende de uniones químicas. Durante este proceso, las plantas utilizan la energía del sol para romper uniones en el agua y el dióxido de carbono, creando glucosa y oxígeno. Sin estas uniones, las plantas no podrían sobrevivir, y, por ende, tampoco nosotros.
La química de los nutrientes en el suelo también depende de las uniones entre átomos. Los minerales y compuestos que las plantas absorben son el resultado de uniones químicas que permiten la transferencia de elementos esenciales para el crecimiento y desarrollo de las plantas.
Preguntas Frecuentes
1. ¿Cuáles son las principales diferencias entre uniones iónicas y covalentes?
Las uniones iónicas se forman por la transferencia de electrones entre átomos, resultando en cargas opuestas que se atraen. Por otro lado, las uniones covalentes implican el compartir electrones entre átomos, creando moléculas más estables.
2. ¿Por qué son importantes las uniones metálicas?
Las uniones metálicas permiten que los metales tengan propiedades únicas, como la conductividad eléctrica y térmica, así como la maleabilidad. Esto los hace esenciales para la construcción, la electrónica y muchas otras aplicaciones.
3. ¿Cómo afectan las uniones químicas a la biología?
Las uniones químicas son fundamentales en los procesos biológicos. Desde la formación de moléculas como el ADN y las proteínas hasta las reacciones metabólicas en las células, todo depende de cómo se unen y reaccionan los átomos.
4. ¿Puede una unión química romperse y formarse nuevamente?
Sí, las uniones químicas pueden romperse y formarse continuamente en una variedad de procesos. Esto es lo que sucede durante las reacciones químicas, donde los enlaces se rompen y se forman nuevos enlaces, creando diferentes sustancias.
5. ¿Qué papel juegan las uniones químicas en la tecnología moderna?
Las uniones químicas son fundamentales en la creación de nuevos materiales, fármacos y tecnologías. Desde la fabricación de semiconductores hasta el desarrollo de nuevos medicamentos, entender cómo se forman y rompen estas uniones es clave para la innovación.
En resumen, las uniones entre átomos y moléculas son mucho más que simples interacciones; son la esencia misma de la materia y la vida. Comprender cómo funcionan nos permite apreciar mejor el mundo que nos rodea y las maravillas de la química que están en juego en cada rincón de nuestro entorno.